Prof. Dr. Manuela Rossol ist seit dem 01.10.2022 neue FGW-Professorin für Molekulare Immunologie an der Brandenburgischen Technischen Universität Cottbus-Senftenberg (BTU).
Das Immunsystem unterliegt altersabhängigen Veränderungen, die für den Alterungsprozess selbst, wie auch für die Entwicklung altersabhängiger Entzündungen, Infektanfälligkeiten, Krebserkrankungen sowie neurodegenerative Prozesse relevant sind.
Auch sogenannte Autoimmunität ist für viele im Alter besonders häufiger Erkrankungen von zentraler Bedeutung, die Zusammenhänge sind zurzeit noch schlecht verstanden. Die neue Professur soll immunologisch relevante Prozesse bei altersassoziierten Erkrankungen molekular untersuchen und aus der Forschung neue Therapieansätze entwickeln.
Standort: B-TU Cottbus-Senftenberg,
Universitätsplatz 1, 01968 Senftenberg
Calcium- und Calciproteinpartikel-vermittelte Differenzierung von Monozyten zu Calcium-Makrophagen
Calcium und Calciproteinpartikel (CPPs) können die Differenzierung von Monozyten zu Calcium-Makrophagen ohne den Zusatz von weiteren Wachstumsfaktoren initieren. Wir untersuchen die Mechanismen, die zu dieser Differenzierung führen, und welche Rolle Calcium-Makrophagen bei verschiedenen Erkrankungen spielen.
Calcium- und Calciproteinpartikel-vermittelte Aktivierung des Nlrp3 Inflammasoms
Wir untersuchen die Mechanismen und die pro-inflammatorischen Konsequenzen einer Aktivierung von Monozyten durch Calcium und Calciproteinpartikel (CPPs) bei Erkrankungen des rheumatischen Formenkreises, Adipositas und kardiovaskulären Erkrankungen. Ziel ist das bessere Verständnis der Aktivierung des Nlrp3 Inflammasoms in diesem Zusammenhang und die Identifizierung von wichtigen Schaltern, um diesen Prozess therapeutisch beeinflussen zu können.
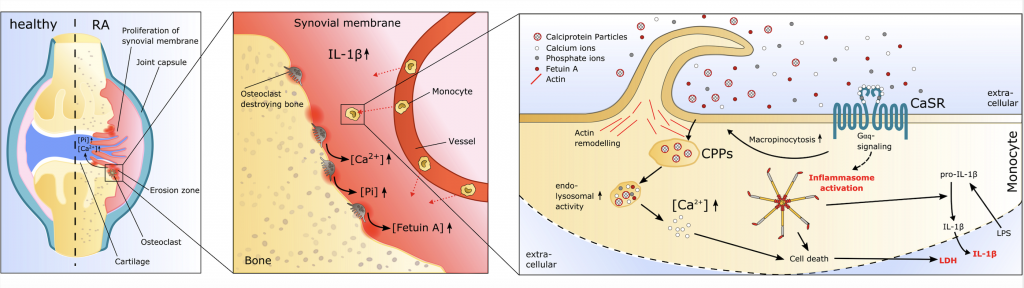
Schematische Zusammenfassung der Hypothese, wie Calcium, Calciproteinpartikel und LPS das Nlrp3-Inflammasom aktivieren (aus Jäger & Murthy et al. Nature Communications 2020).
Immunmetabolische Untersuchungen in Monozyten
Monozyten reagieren auf bakterielle Reize mit einer Umprogrammierung ihres Metabolismus. Krankheitsassoziiert, aber auch durch Umweltschadstoffe, kann diese Umprogrammierung verändert sein und die Funktionen von Monozyten beeinflussen. Ziel ist es, solche Veränderungen zu identifizieren und zu verstehen, um therapeutisch eingreifen zu können bzw. im Fall von Umweltschadstoffen eine Exposition zu vermeiden.
Monozyten Subpopulationen
Monozyten sind keine homogene Zellpopulation, sondern man kann mehrere Subpopulationen im Blut identifizieren. Neben den klassischen Monozyten, gibt es die intermediären und die nicht-klassischen Monozyten, und innerhalb der klassischen Monozyten kann man außerdem die CD56+ Monozyten-Subpopulation finden. Diese Subpopulationen werden stark durch Krankheiten, Altern und Umweltfaktoren beeinflusst. Ziel ist es, solche Veränderungen in den Subpopulationen zu identifizieren und die funktionellen Konsequenzen dieser Veränderungen aufzuklären.
Wahlpflichtmodul “Grundlagen der Immunologie” für Biotechnologie BSc 3. Studienjahr an der B-TU Cottbus- Senftenberg am Standort in Senftenberg
Rückfragen dazu bitte telefonisch über das Sekretariat unter 03573-85841 oder per E-Mail an chris.metzner[at]b-tu.de.
Danger signal extracellular calcium initiates differentiation of monocytes into SPP1/osteopontin-producing macrophages. Murthy S, Karkossa I, Schmidt C, Hoffmann A, Hagemann T, Rothe K, Seifert O, Anderegg U, von Bergen M, Schubert K, Rossol M.Cell Death Dis. 2022 Jan 12;13(1):53. DOI: 10.1038/s41419-022-04507-3
Macrophages in obesity are characterised by increased IL-1β response to calcium-sensing receptor signals. Thrum S, Sommer M, Raulien N, Gericke M, Massier L, Kovacs P, Krasselt M, Landgraf K, Körner A, Dietrich A, Blüher M, Rossol M, Wagner U. Int J Obes (Lond) 2022 Oct;46(10):1883-1891. DOI: 10.1038/s41366-022-01135-x
Calcium-sensing receptor-mediated NLRP3 inflammasome response to calciprotein particles drives inflammation in rheumatoid arthritis. Jäger E, Murthy S, Hahn M, Strobel S, Schmidt C, Peters A, Stäubert C, Sungur P, Venus T, Geisler M, Radusheva V, Raps S, Rothe K, Scholz R, Jung S, Pierer M, Seifert O, Chang W, Estrela-Lopis I, Raulien N, Krohn K, Sträter N, Hoeppener S, Schöneberg T, Rossol M, Ulf Wagner U (shared authorship). Nature Communications. 2020 Aug 25;11(1):4243. DOI: 10.1038/s41467-020-17749-6
Perturbation of the Monocyte Compartment in Human Obesity. Friedrich K, Sommer M, Strobel S, Thrum S, Blüher M, Wagner U, Rossol M. Front Immunol. 2019 Aug 8;10:1874 DOI: 10.3389/fimmu.2019.01874
Fatty Acid Oxidation Compensates for Lipopolysaccharide-Induced Warburg Effect in Glucose-Deprived Monocytes. Raulien N, Friedrich K, Strobel S, Rubner S, Baumann S, von Bergen M, Körner A, Krueger M, Rossol M, Wagner U (shared authorship). Front Immunol. 2017 May 29;8:609. DOI: 10.3389/fimmu.2017.00609
GPRC6A mediates Alum-induced Nlrp3 inflammasome activation but limits Th2 type antibody responses. Quandt D, Rothe K, Baerwald C, Rossol M. Sci Rep. 2015 Nov 25;5:16719. DOI: 10.1038/srep16719
Extracellular Ca2+ is a danger signal activating the NLRP3 inflammasome through G protein-coupled calcium sensing receptors.Rossol M, Pierer M, Raulien N, Quandt D, Meusch U, Rothe K, Schubert K, Schöneberg T, Schaefer M, Krügel U, Bräuner-Osborne H, Baerwald C, Wagner U. Nature Communications. 2012;3:1329. DOI: 10.1038/ncomms2339
Link zu Pubmed mit allen Publikationen von M. Rossol: Pubmed